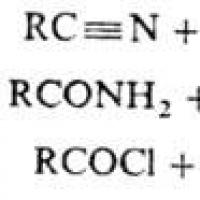Омыление жиров уравнение реакции. Процесс омыления и примеры расчетов
1. Реакция гидролиза или омыления.
Реакция этерификации является обратимой, поэтому в присутствии кислот будет протекать обратная реакция, называемая гидролизом, в результате которой образуются исходные жирные кислоты и спирт:
Реакция гидролиза ускоряется под действием щелочей; в этом случае гидролиз необратим:
так как получающаяся карбоновая кислота со щелочью образует соль:
2. Реакция присоединения.
Сложные эфиры, имеющие в своем составе непредельную кислоту или спирт, способны к реакциям присоединения. Например, при каталитическом гидрировании они присоединяют водород.
3. Реакция восстановления.
Восстановление сложных эфиров водородом приводит к образованию двух спиртов:
4. Реакция образования амидов.
Под действием аммиака сложные эфиры превращаются в амиды кислот и спирты:
Механизм протекания реакции этерификации. Рассмотрим в качестве примера получение этилового эфира бензойной кислоты:
Каталитическое действие серной кислоты состоит в том, что она активирует молекулу карбоновой кислоты. Бензойная кислота протонируется по атому кислорода карбонильной группы (атом кислорода имеет неподеленную пару электронов, за счет которой присоединяется протон). Протонирование приводит к превращению частичного положительного заряда на атоме углерода карбоксильной группы в полный, к увеличению его электрофильности. Резонансные структуры (в квадратных скобках) показывают делокализацию положительного заряда в образовавшемся катионе. Молекула спирта за счет своей неподеленной пары электронов присоединяется к активированной молекуле кислоты. Протон от остатка спирта перемещается к гидроксильной группе, которая при этом превращается в «хорошо уходящую» группу Н 2 О. После этого отщепляется молекула воды с одновременным выбросом протона (возврат катализатора).
Как известно из общей химии, реакция между двумя или. несколькими веществами происходит при их непосредственном контакте. Скорость реакции зависит от количества веществ, соприкасающихся между собой в единицу времени. Наилучшие условия для проведения химических реакций создаются, когда компоненты, участвующие в реакции, находятся в растворе.
Скорость омыления нейтральных жиров едкими щелочами. Жиры практически нерастворимы ни в воде, ни в водном растворе едкой щелочи, поэтому при добавлении раствора щелочи к жиру образуются два слоя: вверху - жир, внизу- раствор щелочи. Реакция между ними в этих условиях происходит только на границе их соприкосновения. Поскольку эта пограничная поверхность очень мала по отношению к массе жира, реакция омыления протекает медленно.
Для ускорения реакции необходимо, чтобы вся масса жира и раствора щелочи пришла в максимально тесное соприкосновение друг с другом. Этого достигают путем их энергичного перемешивания. В результате перемешивания жир разбивается на мельчайшие капельки, которые распределяются в растворе щелочи. При очень сильном дроблении капелек жира они образуют эмульсию, которая представляет собой взвесь капель одной жидкости в другой, с ней не смешивающейся. Чем меньше диаметр капелек жира, т. е. чем больше дисперсность частиц эмульсии, тем она устойчивее, тем быстрее протекает реакция омыления. В очень тонких эмульсиях реакция омыления протекает в 20-30 раз быстрее, чем в грубых.
Эмульсии жира и водного раствора щелочи легко разрушаются под влиянием разных причин - высокой температуры, повышенной концентрации растворов щелочи и соли и др.
Для получения устойчивой эмульсии в обрабатываемую - смесь добавляют вещества, называемые эмульгаторами. При омылении жиров эмульгатором служит само мыло, образующееся в начальный период омыления или специально вводимое в аппарат. Поддержание устойчивой эмульсии - основное условие нормального и быстрого омыления жиров.
Скорость реакции омыления триглицеридов (нейтральных жиров) резко возрастает при наличии в массе 20% мыла и более. Это объясняется тем, что мыльный раствор такой концентрации довольно легко растворяет жиры. Благодаря этому увеличивается контакт между реагирующими веществами, что, как известно, ведет к ускорению реакции. Этот фактор имеет также существенное значение для организации непрерывного процесса варки мыла.
Скорость реакции увеличивается с повышением температуры. Но, поскольку первоначальный период реакции омыления протекает в эмульсии, устойчивость которой понижается с повышением температуры, сначала омыление следует вести при относительно невысокой температуре (60-80°С). После получения в реакционной среде достаточного количества мыла температуру в аппарате повышают до 100-105°С.
Реакция омыления протекает быстрее при повышении концентрации раствора едкой щелочи. В начале процесса омыления применяют растворы щелочи небольшой концентрации, примерно в 2 раза ниже предельной, а когда в реакционной массе содержание омыленного жира повышается до 20% от загружаемой жировой смеси, концентрацию раствора увеличивают.
Для каждой жировой смеси существует своя определенная, оптимальная, концентрация щелочи, которая должна быть на 1- 2% ниже предельной (см. с. 47 «Действие электролитов на мыльный клей»).
Триглицериды, в состав которых входят высокомолекулярные кислоты, омыляются труднее по сравнению с триглицеридами, в состав которых входят кислоты более низкой молекулярной массы.
На рис. 1 приведена кривая, характеризующая скорость омыления жиров.
Из рисунка видно, что в первый период (до образования начального количества мыла) процесс идет сравнительно медленно и кривая поднимается полого (участок 1). Этот этап соответствует эмульсионному периоду, когда скорость омыления зависит от образования устойчивой эмульсии. После омыления примерно 20% загруженных жиров, когда жиры растворяются в омыляемой массе, наступает второй этап - быстрое омыление, и кривая круто поднимается вверх (участок 2). К моменту, когда в реакцию вступает примерно 80-85"% всех жиров, скорость реакции омыления заметно уменьшается (участок 3). Это происходит, во-первых, из-за снижения концентрации едкой щелочи и жира к этому мо
менту и, во-вторых, в мыльной массе повышается концентрация
Глицерина.
Когда в реакционной массе остается сравнительно небольшое количество неомыленного жира, скорость реакции падает и последний отрезок кривой идет почти параллельно горизонтальной линии (участок 4).
Реакция омыления нейтральных жиров является экзотермической, т. е. при омылении выделяется большое количество тепла.
Поэтому после омыления примерно 20% всей жировой смеси, когда процесс идет наиболее энергично, загрузку остальной части жиров и раствора едкой щелочи можно вести при выключенном паре, так как выделяющегося тепла достаточно для поддержания высокой температуры и кипения мыльной массы. Это обеспечивает экономию пара и предохраняет мыльную массу от выброса из котла.
Скорость нейтрализации и доомыления расщепленных жиров едкими щелочами. Расщепленные жиры состоят из 92-96% жирных кислот и 4-8% нейтральных жиров (триглицеридов). Омыление этой смеси раствором едкой щелочи происходит значительно быстрее, чем нейтрального жира. В этом случае процесс проходит в две стадии: I стадия - моментальная нейтрализация жирных кислот при их соприкосновении с раствором едкой щелочи и сравнительно быстрое омыление основной массы нейтрального жира, находящегося в растворе мыла; II стадия - замедленное доомыление небольшого количества оставшегося нейтрального жира и жирных кислот при незначительном избытке свободной едкой щелочи (см. рис. I участок 3).
В целом реакция заканчивается примерно в 2 раза быстрее, чем при омылении нейтрального жира.
Скорость нейтрализации жирных кислот углекислыми щелочами. Для достижения максимальной скорости нейтрализации жирных кислот в открытом аппарате процесс необходимо вести при следующих условиях: температура реакционной массы должна
Быть не ниже 100°С; массу следует интенсивно перемешивать острым паром или воздухом; из реакционной среды необходимо возможно быстрее отводить выделяющийся углекислый газ; раствор углекислой соды должен быть возможно более высокой концентрации; подачу жирных кислот и раствора щелочи надо вести сверху через душевые кольца.
При нейтрализации жирных кислот, не содержащих нейтрального жира, реакция идет почти моментально и скорость процесса
В целом ограничивается только техническими причинами, т. е. возможностью по времени обеспечить соблюдение указанных условий ведения процесса.
Лабораторная работа № 6
Свойства липидов
Опыт 1. Эмульгирование жира.
Принцип метода. При взбалтывании жира с водой, раствором желчи, белка, мыла, соды образуется эмульсия. Вода с жиром дает нестойкую, а остальные растворы стойкую эмульсию.
Это обусловлено тем, что поверхностно – активные частицы желчных кислот, белка, мыла обволакивают капельки жира и препятствуют их слиянию. Эмульгирование жира содой обусловлено образованием мыла в результате взаимодействия углекислого натрия с присутствующими в жире свободными жирными кислотами.
Порядок выполнения работы.
В 4 пробирки наливают по 1 мл: в первую – дистиллированной воды, во вторую – 1% раствора яичного белка, в третью – 1% раствора мыла, в четвертую – 1% раствора углекислого натрия Na 2 CO 3 10H 2 O. В каждую пробирку добавляют по 2 капли растительного масла и тщательно взбалтывают.
Результаты работы заносят в таблицу:
Примечание: Степень эмульгирования выражают знаком плюс (+),
Отсутствие эмульгирования выражают знаком минус (–).
Опыт 2. Омыление жиров (гидролиз).
В результате гидролиза происходит расщепление связей в молекулах глицеридов при действии воды, причем элементы воды присоединяются по месту возникающих свободных валентностей с образованием двух структурных элементов жиров - жирных кислот и глицерина. Участвующая в реакции вода диссоциирует на водород и гидроксил. Водород присоединяется к кислотному остатку, а гидроксил - к спиртовому радикалу. Практически процесс распада триглицеридов протекает последовательно, с образованием промежуточных продуктов реакции – моно- и диглицеридов:
Глубина гидролитического распада определяется содержанием свободных жирных кислот и характеризуется величиной кислотного числа жира (КЧ).
Скорость гидролитического расщепления жиров находится в прямой зависимости от концентрации водородных ионов, которые, как и ионы гидроксила, являются катализаторами этой реакции. Процесс гидролиза протекает значительно быстрее в присутствии некоторых металлов или их оксидов, например Zn, ZnO, CaO, MgO.
Низкомолекулярные кислоты сильно меняют вкус и запах жира. По этим изменениям и определяется пищевая порча жира. Из-за гидролиза особенно сильно изменяются органолептические показатели коровьего и кокосового масел, имеющих в своем составе низкомолекулярные летучие жирные кислоты. Высокомолекулярные жирные кислоты вкуса и запаха не имеют, а потому увеличение их содержания при гидролизе не изменяет органолептических показателей жира.
Принцип метода. Омыление – это гидролиз сложных эфиров под действием щёлочи. При этом получается соль органической кислоты (мыло, т. е. смесь солей высших жирных кислот) и спирт (глицерин – трёхатомный спирт)
Омыление жиров производится в автоклавах, щелочью или ферментативным путем (фермент липаза). Быстрее омыление происходит в водно-спиртовом растворе и спиртово-щелочном растворе.
Схема омыления жира:
Порядок выполнения работы.
В пробирку отвешивают 2 г. жира и приливают 5 мл. 1%-ного спиртового раствора щелочи. Пробирку закрывают пробкой со стеклянной трубой (холодильником) и ставят в водяную баню на 10-12 мин. при (t=80 o C). После окончания омыления (образуется однородный раствор мыла) смесь выливают в фарфоровую чашку, добавляют воду и при нагревании на водяной бане удаляют спирт.
Полученный раствор мыла используют для определения составных частей жира.
Оформление опыта: результат опыта и уравнение реакции записывают в тетрадь.
Мухранов Евгений
Изучили структуру с свойства мыла, получили в школьной лаборатории
Скачать:
Предварительный просмотр:
МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧЕРЕЖДЕНИЕ.
МОРОЗОВСКАЯ СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА
ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА
по теме:
«Структура и свойства мыла. Омыление жиров »
Выполнил: Мухранов Е.В.
Ученик 11 класса.
Руководитель:Скопич С.А.
С Морозовка. 2014
1. Введение
2. История мыла
3. Химические аспекты мыловарения
4. Способы приготовления мыла в промышленности
5. Омыление жиров в школьной лаборотории
6. Воздействие мыла на кожу
7. Заключение
8. Список литературы
Введение
Безусловно, соблюдение личной гигиены было и остаёться залогом здоровья. Мыло - единственное косметическое средство, которым мы пользуемся чаще всего. А значит, оно оказывает большое воздействие на нашу кожу. Несмотря на все новшества, основной принцип изготовление мыла остается тем же, что и несколько тысяч лет назад: оно образуется при переваривании животных или растительных жиров со щелочами.
Цель работы:
Изучить процесс мыловарения и приготовить мыло в рамках школьной лаборатории.
Изучить воздействие мыла на организм человека
задача:
- Изучить строение и свойства мыла.
- Изучить исторические преобразования мыла с древних времён до наших дней.
- Получить мыло в школьной лаборатории.
- Теоретически изучить влияние мыла на кожу.
- Проанализировать полученную информацию и сделать вывод.
В своей работе я использовал методы :
1.Изучение теоретическоко материала.
2.Химический эксперимент.
3.Анализ полученного материала
4.Социологический опрос.
ИСТОРИЯ МЫЛА
Мылом человечество пользовалось с незапамятных времен: история мыловарения насчитывает по меньшей мере 6 тыс. годов
Во времена Гомера мыло еще не было известным. Древние греки очищали тело песком - особенно мелким, привезенным с берегов Нила. Древние египтяне умывались с помощью пасты из пчелиного воска, растворенной в воде.
Честь изобретения мыла приписывается сразу нескольким древним народам. Римский ученый и политик Плиний Старший утверждал, что своим знакомством с моющими средствами человечество обязано не высоко-цивилизованным египтянам, и не находчивым грекам или вавилонянам, а диким галльским племенам, с которыми римляне "познакомились ближе" на рубеже нашей эры. По свидетельству историка, галлы делали из сала и золы букового дерева какую-то чудодейственную мазь, которую использовали для очищения и окрашивания волос, а также для лечения кожных заболеваний. Цветное средство - красную краску - получали из глины. Они смазывали свои длинные волосы растительным маслом, в которое добавляли краску. Если в эту смесь доливали воды, образовывалась густая пена, которая чисто отмывала волосы.
Во II столетии эту "мазь" стали использовать для мытья рук,лица и тела в римских провинциях. Древние римлянины в эту смесь добавляли золу морских растений, и выходило настоящее качественное мыло. А до этого древним народам приходилось "выкручиваться", кому как посчастливится: кто-то использовал для мытья заваренную кипятком золу, а кто-то - сок мыльнянки, растения, которое прославилось своей способностью пениться в воде. Однако с этой версией не совпадают недавние открытия ученых. Не так давно подробнейшее описание процесса мыловарения было найдено... на шумерских глиняных табличках, датированных 2500 годом до нашей эры. Способ основывался на смеси из древесной золы и воды, которую кипятили и растапливали в ней жир, получая мыльный раствор.
Другая версия ученых гласит, что мыло все-таки изобрели римлянине. По легенде, само слово мыло (на английском языке - soap) образовалось от названия горы Сапо, где происходило принесение жертв богам. Смесь из растопленного животного жира и древесной золы жертвенного костра смывало дождем в глинистый грунт берега реки Тибр. Женщины, которые стирали там белье, обратили внимание, что благодаря этой смеси одежда отстирывается значительно легче. Так, постепенно стали использовать "дар богов" не только для стирки одежды, но и для мытья тела. Кстати, первые мыловарни тоже были выявлены археологами на территории Древнего Рима, а еще точнее - среди руин знаменитой Помпеи. Во время археологических раскопок Помпеи были найдены помещения мыловарен. Мыло в ту пору было полужидким.
Мыло долго было предметом роскоши и ценилось наряду с дорогими лекарствами и зельями. Но даже зажиточные люди не могли себе позволить стирать им белье. Для этого использовали разные глины, растения. Стирка была трудным делом, и занимались ею чаще всего мужчины. Итак, споры о том, кому человечество обязано изобретением мыла, до сих пор не завершены. Тем не менее известно, что "на поток" производство моющих средств было поставлено в средневековой Италии. Через сто лет секреты этого ремесла достигли Испании, а с XI ст. центром мыловарения становится Марсель, потом Венеция.
Правда, нельзя сказать, чтобы средневековые жители европейских стран злоупотребляли чистотой: мылом пользовались только представители первых двух слоев - дворяне и священники, да и то не все поголовно. Моду на чистоту привезли в Европу рыцари, которые побывали во время крестовых походов в арабских странах. Именно поэтому с XIII столетие и начинается расцвет производства моющих средств сначала во Франции, а потом в Англии. К делу мыловарения относились с чрезмерной серьезностью.
Когда этому ремеслу научились в Англии, король Генрих IV даже издал закон, который запрещал мыловару ночевать под одной крышей с другими ремесленниками: способ мыловарения держался в тайне. Но в больших масштабах мыловарение развилось лишь после разработки промышленного получения мыла. Первый кусок твердого мыла выпустили в Италии в 1424 году.
Утро французского короля Людовика XIV начиналось с многочасового ритуала одевания и очень короткого умывания. Ему подносили большую великолепную чашу, на дне которой плескалась вода. Король смачивал кончики пальцев и слегка дотрагивался ими до век. На этом процедура заканчивалась - мыться целиком в те времена было не принято, зато душиться различными духами было насущной необходимостью.
Франции, использовали для создания причесок из своих длинных волос особую смесь растительного масла и красной земляной краски. Стоило на смесь попасть воде, как образовывалась густая пена. Ее оставалось смыть - и вот они, чистые, блестящие, пушистые волосы!
Скифские женщины делали моющий порошок из древесины кипариса и кедра, затем смешивали его с водой и ладаном. Полученной нежной мазью, имевшей тонкий аромат, они натирали все тело. Затем удаляли раствор скребками, и кожа становилась чистой и гладкой. Хотя мыло уже было изобретено, многие народы еще долго продолжали пользоваться щелоком, бобовой мукой, клеем, пемзой, ячменной закваской и глиной. Даже знаменитый арабский врач Ибн Сина, живший в XI веке, советовал пользоваться мылом только для обмывания прокаженных. Здоровым же он предлагал глину. Кстати, подручные средства, заменяющие мыло, люди используют до сих пор. Земля одного из островов в Эгейском море содержит моющее вещество, с помощью которого жители борются с грязью. Когда идет дождь, весь остров покрывается мыльной пеной.
Но вернемся к истории мыла. В средние века основными его поставщиками в Европе были города Неаполь и Марсель. Постепенно ремеслу варки мыла научились и в других местах. Отношение к этому ремеслу было самое серьезное. В 1399 году в
Англии король Генрих IV основал орден, особой привилегией членов которого считалось… мытье в бане с мылом. В этой стране долгое время под страхом смерти члену гильдии мыловаров запрещалось ночевать под одной крышей с мастерами других ремесел - дабы не выдать тайну. Во второй половине XVII века во Франции был издан королевский указ, разрешающий варку мыла только в летнее время и только из золы и оливкового масла.
В России мыло начали делать во времена Петра I, но вплоть до середины XIX века им пользовалась только знать. Крестьяне стирали и мылись щелоком – древесную золу заливали кипятком и распаривали в печке. Главным центром мыловарения был город Шуя, на его гербе даже изображен кусок мыла. Широко известны были и московские фирмы - фабрика Ладыгина, фабрика Альфонса Ралле "Ралле и К" и парфюмерная фабрика Брокара, Оборудование фабрики Брокара поначалу состояло из трех котлов, дровяной печи и каменной ступки. Но он сумел стать признанным "королем парфюмерии", выпустив дешевое, копеечное мыло для всех слоев населения. Брокар старался придать недорогой продукции привлекательный вид. Например, его мыло "огурец" так походило на настоящий овощ, что покупалось даже из одного любопытства.
ХИМИЧЕСКИЕ АСПЕКТЫ МЫЛОВАРЕНИЯ
Несмотря на то что в конце эпохи средневековья в разных странах существовала довольно развитая мыловаренная промышленность, химическая сущность процессов, конечно, была не ясна. Лишь на рубеже XVIII и XIX вв. была выяснена химическая природа жиров и внесена ясность в реакцию их омыления. В 1779 г. шведский химик Шееле показал, что при взаимодействии оливкового масла с оксидом свинца и водой образуется сладкое и растворимое в воде вещество. Решающий шаг на пути изучения химической природы жиров был сделан французским химиком Шеврелем. Он открыл стеариновую, пальмитиновую и олеиновую кислоты, как продукты разложения жиров при их омылении водой и щелочами. Сладкое вещество, полученное Шееле, было Шеврелем названо глицерином. Сорок лет спустя Бертло установил природу глицерина и объяснил химическое строение жиров. Глицерин – трехатомный спирт. Жиры – сложные эфиры глицерина (глицериды) тяжелых одноосновных карбоновых кислот, преимущественно пальмитиновой CH 3 (CH 2 ) 14 COOH, стеариновой CH 3 (CH 2 ) 16 COOH и олеиновой CH 3 (CH 2 ) 7 CH = CH(CH 2 ) 7 COOH. Их формулу и реакцию гидролиза можно описать следующим образом:
В состав различных жиров входят в различных соотношениях пальмитиновая, стеариновая, олеиновая и другие кислоты. В растительных (жидких) жирах преобладают непредельные кислоты (содержащие этиленовые связи), а в животных (твердых) – предельные кислоты, т.е. не содержащие двойных связей. Потребности в твердых животных жирах большие, чем в растительных. Поэтому жидкие растительные жиры переводят в твердые каталитической гидрогенизацией. В этом процессе остатки непредельных кислот в глицеридах превращаются (присоединением водорода) в остатки предельных кислот. Например:
CH 3 (CH 2 ) 7 CH = CH(CH 2 ) 7 COOH | [катализатор
190...240°C] ↓ CH 3 (CH 2 ) 7 CH 2 – CH 2 (CH 2 ) 7 COOH
Именно так получают кулинарные жиры, масло для обжаривания, салатное масло, а также жиры, идущие на производство маргарина. Гидрированные жиры называют саломаслами (сало из масла).
Важно то, что среди остатков различных кислот в глицеридах (жирах) присутствует остаток линолевой кислоты CH 3 (CH 2 ) 4 CH = CHCH 2 CH 2 CH = CH(CH 2 ) 7 COOH. В отличие от других эта кислота не синтезируется в организме человека, а вводится только с пищей. В настоящее время существует утвердившееся мнение, что линолевая кислота необходима для предотвращения атеросклероза – распространенной болезни, служащей одной из главных причин потери трудоспособности и преждевременной смерти. Необходимо отметить, что линолевая кислота непредельная, а значит, она входит в состав главным образом растительных жиров.
В быту, не говоря о промышленности, мойке подвергают разные предметы и объекты. Загрязняющие вещества бывают самые разнообразные, но чаще всего они малорастворимы или нерастворимы в воде. Такие вещества, как правило, являются гидрофобными, поскольку водой не смачиваются и с водой не взаимодействуют. Поэтому нужны и различные моющие средства.
Если попытаться дать определение, то мытьем можно назвать очистку загрязненной поверхности жидкостью, содержащей моющее вещество или систему моющих веществ. В качестве жидкости в быту используют главным образом воду. Хорошая моющая система должна выполнять двойную функцию: удалять загрязнение с очищаемой поверхности и переводить его в водный раствор. Значит, моющее средство также должно обладать двойной функцией: способностью взаимодействовать с загрязняющим веществом и переводить его в воду или водный раствор. Следовательно, молекула моющего вещества должна иметь гидрофобную и гидрофильную части. Фобос – по-гречески означает страх, боязнь. Значит, гидрофобность означает боящийся, избегающий воду. Филео – по-гречески – люблю, а гидрофильность – любящий, удерживающий воду. Гидрофобная часть молекулы моющего вещества обладает способностью взаимодействовать с поверхностью гидрофобного загрязняющего вещества. Гидрофильная часть моющего вещества взаимодействует с водой, проникает в воду и увлекает с собой частицу загрязняющего вещества, присоединенную к гидрофобному концу.
Таким образом, моющие вещества должны обладать способностью адсорбироваться на пограничной поверхности, т.е. обладать поверхностной активностью. Их называют поверхностно-активными веществами (ПАВ).
Соли тяжелых карбоновых кислот, например CH 3 (CH 2 ) 14 COONa, являются типичными поверхностно-активными веществами. Они содержат гидрофильную часть (в данном случае – карбоксильную группу) и гидрофобную часть (углеводородный радикал).
Животные жиры – древнее и весьма ценное сырье мыловаренной промышленности. Они содержат до 40% (насыщенных) жирных кислот. Искусственные, т.е. синтетические, жирные кислоты получают из парафина нефти каталитическим окислением кислородом воздуха. В упрощенном виде реакцию можно описать следующим уравнением:
CH 3 (CH 2 ) m CH 2 – CH 2 (CH 2 ) n CH 3 + 2,5O 2 ↓ CH 3 (CH 2 ) m COOH + CH 3 (CH 2 ) n COOH + H 2 О
Молекула парафина при окислении разрывается в разных местах и потому получается смесь кислот, которые разделяются на фракции. При производстве мыла используют две фракции: C 10 –C 16 и C 17 –C 20 . В хозяйственное мыло синтетические кислоты вводят в количестве 35...40%. Для производства мыла также применяют нафтеновые кислоты, выделяемые при очистке нефтепродуктов (бензина, керосина и др.). С этой целью нефтепродукты обрабатывают раствором гидроксида натрия и получают водный раствор натриевых солей нафтеновых кислот (монокарбоновые кислоты ряда циклопентана и циклогексана). Этот раствор упаривают и обрабатывают поваренной солью, в результате чего на поверхность раствора всплывает мазеобразная масса темного цвета – мылонафт. Для очистки мылонафт обрабатывают серной кислотой, т.е. вытесняют из солей сами нафтеновые кислоты. Этот нерастворимый в воде продукт называют асидолом или асидол-мылонафтом. Непосредственно из асидола можно изготавливать только жидкое или, в крайнем случае, мягкое мыло. Оно имеет нефтяной запах, но зато обладает бактерицидными свойствами.
В производстве мыла давно используют канифоль, которую получают при переработке живицы хвойных деревьев. Канифоль состоит из смеси смоляных кислот, содержащих в цепи около 20 углеродных атомов. В рецептуру хозяйственного мыла обычно вводят 12...15% канифоли от массы жирных кислот, а в рецептуру туалетных мыл – не более 10%. Введение канифоли в больших количествах делает мыло мягким и липким.
Процесс производства мыла состоит из химической и механической стадий. На первой стадии (варка мыла) получают водный раствор солей натрия (реже калия) жирных кислот или их заменителей (нафтеновых, смоляных). На второй стадии проводят механическую обработку этих солей – охлаждение, сушку, смешивание с различными добавками, отделку и упаковку.
Варку мыла заканчивают обработкой мыльного раствора (мыльного клея) избытком щелочи (NaOH) или раствором NaCl. В результате этого на поверхность раствора всплывает концентрированный слой мыла, называемый ядром. Полученное таким образом мыло называют ядровым, а процесс его выделения из раствора – отсолкой или высаливанием. При высаливании происходит повышение концентрации мыла и его очистка от белковых, красящих и механических примесей – так получают хозяйственное мыло.
Если мыло варилось из животных или растительных жиров, то из раствора после отделения ядра выделяют образующийся в результате омыления глицерин. Он находит широкое и разнообразное применение: в производстве взрывчатых веществ (тринитроглицерина) и полимерных смол; в качестве умягчителя тканей и кожи; для парфюмерных, косметических и медицинских препаратов; при производстве кондитерских изделий и ликеров. Последним он придает вязкую консистенцию.
Для получения особо чистого и светлого мыла его очищают (шлифуют) переведением снова в раствор кипячением с горячей водой и повторным высаливанием. В результате шлифования мыло приобретает большую однородность, низкую вязкость и надлежащую пластичность. Для изготовления туалетного мыла в очищенном ядровом мыле снижают содержание воды от 30 до 12%. Затем в него вводят парфюмерные отдушки, отбеливатели типа TiO 2 , красители и др. Хорошие сорта туалетного мыла содержат до 50% мыла, полученного из импортного кокосового или пальмового масла. Кокосовое масло хорошо растворяется в холодной воде и характеризуется высоким пенообразованием. Иногда туалетное мыло содержит до 10% свободных жирных кислот. Самое дорогое туалетное мыло целиком изготавливают из кокосового масла.
Для улучшения некоторых характеристик хозяйственного мыла (иногда и туалетного), а также для удешевления в него вводят наполнители. К ним относятся некоторые натриевые соли (Na 2 CO 3 , Na 2 B 4 O 7 , Na 5 P 3 O 10 , жидкое стекло), которые при растворении в воде приводят к подщелачиванию, клеи (казеин, казеиновый студень), углеводы (крахмал). Клеи и крахмал способствуют пенообразованию мыльного раствора и стойкости пены, однако моющей способностью не обладают. Для получения паст в жидкое хозяйственное мыло вводят тонкоизмельченный песок, толченый кирпич, жирные глины. Они способствуют механической очистке. Такие мыла применяют для чистки кухонной посуды, некрашеной мебели, полов и т.д.
Особое место среди наполнителей занимает сапонин, получаемый выщелачиванием некоторых растений и прежде всего мыльного корня. Он хорошо растворяется в воде и его растворы сильно пенятся. Поэтому сапонин используют для улучшения пенообразования и применяют для дорогих сортов мыл.
Следует отметить, что замена натрия на калий приводит к изменению консистенции мыла. Из твердого оно становится мягким или мазеобразным.
Ионы кальция и магния образуют с анионами тяжелых карбоновых кислот малорастворимые соли. Этот процесс можно выразить уравнениями:
2RCOONa + Ca(HCO 3 ) 2 = Ca(RCOO) 2 + 2NaHCO 3
2RCOONa + MgCl 2 = Mg(RCOO) 2 + 2NaCl
Поэтому при стирке белья в жесткой воде, содержащей эти ионы, расход мыла повышается на 25...30%. Малорастворимые соли кальция и магния оседают на ткани, забивают поры и потому делают ткань грубой, менее эластичной, с плохой воздухо- и влагопроницаемостью. Такие ткани приобретают сероватый оттенок, а окраска становится блеклой. Кроме того, осевшие на ткани известковые мыла приводят к снижению ее прочности. Это происходит потому, что анионы ненасыщенных карбоновых кислот при сушке тканей окисляются кислородом воздуха с образованием веществ пероксидного характера. Они же окисляют целлюлозу, из которой состоят ткани. Для устранения вредных последствий жесткой воды в мыла вводят натрийтрифосфат Na 5 P 3 O 10 . Анион P 3 O 5 10 – связывает ионы Ca 2+ и Mg 2+ в прочные, но растворимые в воде соединения. По существу они играют роль умягчителя воды. С этой же целью натрийтрифосфат и другие полифосфатные анионы добавляют и в стиральные порошки.
Кроме использования мыла в качестве моющего средства оно широко применяется при отделке тканей, в производстве косметических средств, для изготовления полировочных составов и водоэмульсионных красок. Имеется и не столь безобидное его применение. Алюминиевое мыло (алюминиевые соли смеси жирных и нафтеновых кислот) применяют в США для получения некоторых видов напалма – самовоспламеняющегося состава, используемого в огнеметах и зажигательных авиабомбах. Само слово напалм происходит от начальных слогов нафтеновой и пальмитиновой кислот. Состав напалма довольно простой – это бензин, загущенный алюминиевым мылом.
В настоящее время химическая промышленность выпускает большое количество различных синтетических моющих средств (стиральных порошков). Наибольшее практическое значение имеют соединения, содержащие насыщенную углеводородную цепь из 10...15 атомов углерода, так или иначе связанную с сульфатной или сульфонатной группой, например
Производство синтетических моющих средств основано на дешевой сырьевой базе, а точнее на продуктах переработки нефти и газа. Они, как правило, не образуют малорастворимых в воде солей кальция и магния.
Следовательно, многие из синтетических моющих средств одинаково хорошо моют как в мягкой, так и в жесткой воде. Некоторые средства пригодны даже для стирки в морской воде. Синтетические моющие средства действуют не только в горячей воде, как это характерно для хозяйственного мыла, но и в воде при сравнительно низких температурах, что важно при стирке тканей из искусственных волокон. Наконец, концентрация синтетических моющих веществ даже в мягкой воде может быть гораздо ниже, чем мыла, полученного из жиров. Синтетические моющие средства обычно представляют довольно сложную композицию, поскольку в них входят различные добавки: оптические отбеливатели, химические отбеливатели, ферменты, пенообразователи, смягчители.
СПОСОБЫ ПРИГОТОВЛЕНИЯ
Изготовление мыла не связанно с фабричным оборудыванием, поэтому его можно приготовить как в лаборатории, так и дома.
В лаборатории Морозовской МБОУ СОШ я получил два вида мыла.
Первый способ заключается в щелочном гидролизе растительного масла.
Ход работы: . Горячий крепкий раствор стиральной соды наливаем в склянку и прибавляемпо каплям растительное масло, пока оно не перестанет растворяться. В полученный раствор всыпаем немного поваренной соли (процесс так и называется - высаливание). Твердое мыло всплывет на поверхность, его легко собрать
Результат : из 40 мл раствора образовалось всего 8 грамм мыла. Следовательно данный способ экономически не выгоден.
Второй способ заключается в щелочном гидролизе сливочного масла.
Ход работы: Прежде всего отвесим на химических весах 20 г. сливочного масла.Положимего в фарфоровую чашку (объемом 0,5 л). Отмеримв медном цилиндре 60 мм 30 процентного раствора щелочи и осторожно вольём его в чашку с раствором. Поставим чашку с содержимым на асбестовую сетку штатива и нагревайте ее, перемешивая стеклянной палочкой, так, чтобы не было разбрызгивания. (РАБОТАЙТЕ В ПРЕДОХРАНИТЕЛЬНЫХ ОЧКАХ!)
По мере выкипания добавим в чашку понемногу воды. Через 1-1,5 часа возьмиём пробу. Здесь два способа: при одном вы берете пробу (0,5-1 мл) пипеткой н выливаете ее в пробирку с горячей дистиллированной водой. Про бирку встряхиваете. Если мыло готово, проба полностью растворится в горячей воде. Образуется обильная пена. Если же оно не готово, раствор будет непрозрачным, сверху всплывет жир. При другом способе пробу берут стеклянной палочкой и капают на ноготь большого пальца левой руки. Если капля застывает, не расплываясь, мыло готово, если же она расплывается - варку надо продолжить .
Когда мыло сварится, упарьте его на медленном огне (10-15 минут). Затем охладите и вылейте в сосуд с насыщенным раствором поваренной соли. В виде мыльных хлопьев оно всплывет на поверхность. Фарфоровой ложкой соберите мыло, промойте холодной водой от избытка щелочи, перенесите на тряпку, отожмите и спрессуйте в кусок или опять перенесите в фарфоровую чашку, осторожно расплавьте и вылейте в форму (деревянная коробочка). Застывшее и подсохшее мыло готово к употреблению.
Результат : на фильтровальной бумаге обрадовалось мыло, н раствор фенолфталеина показал наличие щёлочи в мыле. Следовательно, щёлочь вступила в реакцию не полностью.
Воздействие мыла на кожу:
Современные исследования показывают, что чем меньше в мыле всевозможных красителей, отдушек, тем меньше угроза раздражения кожи. Многие элитные косметические компании вообще отказались от добавления в мыло искусственных компонентов. Исключение составляет мыло с отшелушивающим эффектом. Мыло-скраб может содержать дробленые косточки малины или измельченные орешки, а также синтетическую крошку, которая очень мягко удаляет отмершие клетки кожи, не повреждая живых тканей. Отшелушивающее мыло хорошо использовать перед применением других косметических средств (питательных масок, кремов), так как глубоко очищенная кожа лучше впитает полезные вещества.
О качестве моющего средства можно судить по уровню его рН, который должен приближаться к кислотности здоровой кожи - 5,5-5,6. Однако мыло даже с таким показателем не подходит для чувствительной кожи. После умывания мылом часто возникает ощущение стянутости, а при регулярном использовании кожа может начать шелушиться, стать сухой. Такое воздействие оказывает щелочь, она разрушает защитную липидную пленку, и организму требуется несколько часов на ее восстановление. Особенно много щелочи в дешевых сортах мыла, поэтому не стоит его использовать для лица и тела, но оно вполне подойдет для ежедневного мытья рук, так как кожа рук - самая закаленная.
Для ухода за лицом лучше применять молочко и лосьоны, а для тела - гели для душа. Но уж если вы предпочитаете мыло - выбирайте самое лучшее.
Чтобы мыло не сушило кожу, в него добавляют натуральные вещества, обладающие полезными для кожи свойствами:
Глицериновое мыло смягчает и увлажняет кожу от вредного воздействия окружающей среды. Подходит для проблемной и чувтвительной кожи.
Вазелиновое мыло оставляет на коже защитную пленку, предохраняющую ее от пересыхания
Дегтярное мыло было известно своими свойствами еще в XIX веке. Содержит лечебный берестовый деготь и незаменимо при различных заболеваниях кожи, а также для профилактики.
Медовое мыло восстанавливает, тонизирует, смягчает, омолаживает и питает кожу, делая ее нежной и бархатистой.
Мыло на основе овса, нормализует жирную кожу, предупреждает появление покраснений и раздражений, придает мягкость, прекрасно увлажняет и защищает кожу от вредного воздействия окружающей среды.
Мыло с экстрактом пихты подходит для проблемной кожи, способствует заживлению мелких трещин, предупреждает раздражение и образование угрей.
Мыло с экстрактом ромашки, содержащее флавоноиды, эфирные масла и витамины, укрепляет защитные функции кожи, помогает избежать пересыхания.
Мыло с экстрактами зверобоя и эвкалипта, оказывает эффективное противовоспалительное действие.
Есть мыло, которое варят в небольших количествах по старинным рецептам - так, как его изготовляли до изобретения непрерывного процесса мыловарения. Такое мыло продается в виде грубоватых брусочков, часто оно бывает полупрозрачным, иногда в него вплавлены кусочки натуральных фруктов или овощей. В таком мыле щелочь заменяется мягкими омыляющими компонентами растительного происхождения, поэтому оно не вредит коже.
Соц. Опрос.
1) вы умываетесь с мылом?
ДА-86.7% НЕТ-10.3% КОГДА КАК -3%
2) Что вы чувствуете после умывания с мылом
Легкость.
Свежесть.
Стягивает кожу.
Ничего
Вывод:
В соответствии с поставленной целью, изучена литература по приготовлению мыла в условиях школьной лаборатории.
В ходе работы сделан вывод о том, что приготовление мыла в домашних условиях – процесс трудоемкий, длительный и дорогостоящий, т.к. для получения мыла используются жиры, которые являются ценными продуктами питания.
Выполненная работа позволяет сделать обоснованные выводы о том, что выдвинутая гипотеза верна, а именно: изучение литературы по приготовлению мыла в условиях школьной лаборатории, получение самого хозяйственного мыла, проверка его свойств на практике привели к получению мыла в условиях школьной лаборатории с незначительными отклонениями.
Список литературы:
1.Википедия-свободная энциклопедия - http://ru.wikipedia.org/
2.Декоративное мыло Техника. Приемы. Изделия - Корнилова В.В., изд. АСТ, 2009
3.www.mylko.ru- энциклопедия мыловарения
4.www.magicaltouch.ru - мыло и косметика ручной работы
5.Б.Д.Степин, А.Ю.Алиуберова Занимательные задания и эффектные опыты по химии
6.А.А.Зиновьев Химия жиров
7. Энциклопедия для детей «Химия», М, Аванта 2000г
8. О. Ольгин Занимательные опыты по химии, «Детская литература», 1975г
9. Интернет-ресурсы: http://www.originalsoap.ru
Http://www.mysoap.ru
Предварительный просмотр:
Чтобы пользоваться предварительным просмотром презентаций создайте себе аккаунт (учетную запись) Google и войдите в него: https://accounts.google.com
Подписи к слайдам:
Исследовательская работа: «Состав и свойство мыла. Омыление жиров» Выполнил: Мухранов Е.В. Руководитель: Скопич С.А.
«Уровень культуры нации измеряется количеством потребляемого ею мыла» Юстус фон Либиг
Введение: Мыло - единственное косметическое средство, которым мы пользуемся чаще всего. А значит, оно оказывает большое воздействие на нашу кожу. Несмотря на все новшества, основной принцип изготовление мыла остается тем же, что и несколько тысяч лет назад: оно образуется при переваривании животных или растительных жиров со щелочами.
Цель работы: Изучить процесс мыловарения и приготовить мыло в рамках школьной лаборатории. Изучить воздействие мыла на организм человека.
Задачи: Изучить строение и свойства мыла. Изучить исторические преобразования мыла с древних времён до наших дней. Получить мыло в школьной лаборатории. Теоретически изучить влияние мыла на кожу. Проанализировать полученную информацию и сделать вывод.
Из истории мыловарения: Первый мыловарный завод в Р оссии Древний рецепт мыла Мыловарня во Франции
Из истории мыловарения: Объяснил суть процесса получения мыла в XIX веке французский химик Мишель Шеврель
Химический аспект мыловарения Реакция щелочного гидролиза жиров называется омылением.
Химический аспект мыловарения Олеат натрия (соль непред. олеиновой к-ты) (С 17 н 33 СОО Na) Пальмиат калия (соль пальмитиновой к-ты) (С 15 Н 31 СООК) Линолеат натрия (соль линоленовой к-ты) (С 17 Н 29 СОО Na)
Состав промышленного мыла Натриевые соли жирных кислот Натуральные жиры и масла Ароматическая композиция Вода Пластификаторы Антиоксиданты Отбеливатели Красители
Получение мыла в лаборатории
Опыт№1 Получение мыла из растительного масла:
Опыт №2 Омыление сливочного масла:
Действие мыла на кожу Нормальная кожа – мыло с любой реакцией раствора; Раздражительная кожа – мыло должно быть нейтральное, без красителей и парфюмерных добавок; Сухая кожа – только нейтральное мыло с увлажняющими компонентами, лучше жидкое; Жирная кожа – мыло щелочное; Комбинированная кожа - подбирать разные сорта мыла или использовать специальные косметические средства;
Действие мыла на кожу: На 1 см 2 кожи - до 3 млн. микроорганизмов! Выделения сальных и потовых желез создают благоприятную среду для микробов; Только чистая кожа выделяет защитные вещества, убивающие микроорганизмов
Соц. Опрос: 1) вы умываетесь с мылом? ДА-86.7% НЕТ-10.3% КОГДА КАК -3% 2) Что вы чувствуете после умывания с мылом -легкость. -свежесть. -стягивает кожу. -ничего.
вывод. В соответствии с поставленной целью, изучена литература по приготовлению мыла в условиях школьной лаборатории. В ходе работы сделан вывод о том, что приготовление мыла в домашних условиях – процесс трудоемкий, длительный и дорогостоящий, т.к. для получения мыла используются жиры, которые являются ценными продуктами питания. Выполненная работа позволяет сделать обоснованные выводы о том, что выдвинутая гипотеза верна, а именно: изучение литературы по приготовлению мыла в условиях школьной лаборатории, получение самого хозяйственного мыла, проверка его свойств на практике привели к получению мыла в условиях школьной лаборатории с незначительными отклонениями.
Список литературы: 1.Б.Д.Степин, А.Ю.Алиуберова Занимательные задания и эффектные опыты по химии 2.А.А.Зиновьев Химия жиров 3. Энциклопедия для детей «Химия», М, Аванта 2000г 4. О. Ольгин Занимательные опыты по химии, «Детская литература», 1975г 5. Интернет-ресурсы: http://www.originalsoap.ru http://www.mysoap.ru
«Широко простирает химия руки свои в дела человеческие» М.В.Ломоносов
Спасибо за внимание!
А. Классификация липидов
Липиды - большая группа веществ биологического происхождения, хорошо растворимых в органических растворителях, таких, как метанол, ацетон, хлороформ и бензол. В то же время эти вещества нерастворимы или мало растворимы в воде. Слабая растворимость связана с недостаточным содержанием в молекулах липидов атомов с поляризующейся электронной оболочкой, таких, как О, N, S или P (см. с. 14)
Липиды подразделяются на омыляемые и неомыляемые . Из огромного множества липидов здесь приведены лишь некоторые представители. Отдельные классы липидов обсуждаются в последующих разделах.
Омыляемые липиды. Структурные компоненты омыляемых липидов связаны сложноэфирной связью. Эти липиды легко гидролизуются в воде под действием щелочей или ферментов. Омыляемые липиды включают три группы веществ: сложные эфиры ,фосфолипиды и гликолипиды . В группу сложных эфиров входят нейтральные жиры (глицерин+три жирные кислоты), воски (жирный спирт+жирная кислота) и эфиры стеринов (стерин+жирная кислота). Группа фосфолипидов включает фосфатидовые кислоты (глицерин+две жирные кислоты+фосфатная группа), фосфатиды (глицерин+две жирные кислоты+фосфатная группа+спирт) исфинголипиды (сфингозин+жирная кислота+фосфатная группа+спирт). К группе гликолипидов относятся цереброзиды (сфингозин+жирная кислота+один углеводный остаток) и ганглиозиды (сфингозин+жирная кислота+несколько углеводных остатков, в том числе нейраминовая кислота).
Группа неомыляемых липидов включает предельные углеводороды и каротиноиды , а также спирты . В первую очередь это спирты с длинной алифатической цепью , циклические стерины (например, холестерин) и стероиды (эстрадиол, тестостерон и др.). Важнейшую группу липидов образуют жирные кислоты. К этой группе относятся также эйкозаноиды , которые можно рассматривать как производные жирных кислот
Гидролиз жиров [править | править вики-текст]
Гидролиз для жиров характерен, так как они являются сложными эфирами. Он осуществляется под действием минеральных кислот и щелочей при нагревании. Гидролиз жиров в живых организмах происходит под влиянием ферментов. Результат гидролиза - образование глицерина и соответствующих карбоновых кислот: С 3 H 5 (COO) 3 -R + 3H 2 O ↔ C 3 H 5 (OH) 3 + 3RCOOH
Расщепление жиров на глицерин и соли высших карбоновых кислот проводится обработкой их щёлочью - (едким натром), перегретым паром, иногда - минеральными кислотами. Этот процесс называется омыление жиров (см. Мыло).
С 3 H 5 (COO) 3 -(C 17 H 35) 3 + 3NaOH → C 3 H 5 (OH) 3 + 3C 17 H 35 COONa
тристеарин (жир) + едкий натр → глицерин + стеарат натрия (мыло)
Аналитическая характеристика жиров
Кроме температуры плавления и затвердевания, для характеристики жиров применяются следующие величины: кислотное число, число омыления, йодное число.
Природные жиры нейтральны. Однако при переработке или хранении вследствие процессов гидролиза или окисления образуются свободные кислоты, количество которых непостоянно. Кислотное число представляет собой число миллиграммов гидроксида калия, необходимое для нейтрализации свободных жирных кислот, содержащихся в 1 г жира.
Число омыления равно числу миллиграммов гидроксида калия, расходующихся при омылении 1 г жира кипячением последнего с избытком гидроксида калия в спиртовом растворе. Число омыления чистого триолеина равно 192. Высокое число омыления указывает на присутствие кислот с «меньшими молекулами». Малые числа омыления указывают на присутствие более высокомолекулярных кислот или же неомыляемых веществ. При взаимодействии с щелочами жиры гидролизуются с образованием солей высокомолекулярных кислот, называемых «мылами».
Йодное число выражается числом граммов йода, которое может присоединяться по двойным связям к 100 г жира. Для определения йодного числа применяют растворы хлорида йода ICl, бромида йода IBr, или йода в растворе сулемы, которые более реакционноспособны, чем сам йод. Йодное число является мерой ненасыщенности кислот жиров. Оно важно для оценки качества высыхающих масел.
ОМЫЛЕНИЕ , гидролиз сложного эфира с образованием спирта и к-ты (или ее соли):
Происхождение термина "омыление" связано с методом произ-ва мыла из жиров. Омылением часто наз. гидролитич. превращения любых производных к-т, приводящие к к-там или их солям (омыление нитрилов, амидов,хлорангидридов и т.п.):

Поскольку галогензамещенные углеводороды можно рассматривать как эфиры галогеноводородных к-т, их гидролизтакже часто называют омылением:
Иногда термин "омыление" применяют к др. случаям гидролиза орг. соед., напр. омыление простых эфиров.
32. Высшие жирные кислоты. Мыла. Детергенты. Химические свойства Высшие жирные кислоты (ВЖК), натуральные (природные) и синтетические карбоновые кислоты алифатического ряда с числом атомов углерода в молекуле не менее 6.
Натуральные высшие жирные кислоты - преимущественно одноосновные кислоты нормального строения с четным числом атомов углерода в молекуле; могут быть насыщенными и ненасыщенными (с двойными связями, реже с тройными). Кроме карбоксильной группы, они могут содержать другие функциональные группы, например ОН. Содержатся в животных жирах и растительных маслах в виде сложных эфировглицерина (так называемых глицеридов), а также в природных восках в виде эфиров высших жирных спиртов. Наиболее распространены кислоты с 10-22 атомами углерода в молекуле (см. табл. 1).
Получают натуральные высшие жирные кислоты из жиров и масел. В промышленности используют преимущественно высокотемпературный (200-225 oС) гидролиз под давлением (~ 2,50 МПа), реже - кислотныйгидролиз в присутствии контакта Петрова. В лабораторных условиях высшие жирные кислоты синтезируют кислотным гидролизом в присутствии реактива Твитчеля (смесь олеиновой и серной кислот с бензолом), ферментативным (липазным) гидролизом, омылением растворами гидроксидов металлов I группы с последующим разложением образовавшихся солей (мыл) водными растворами H2SO4 или НСl.
мыла , соли высших жирных (С 8 -С 18), нафтеновых и смоляных кислот; одни из основных моющих средств. Технические смеси водорастворимых (калиевых, натриевых, аммониевых и три-этаноламмониевых) солей этих кислот называют щелочными мылами, водонерастворимые соли, содержащие металлы II, III и других групп (например, Са, Mg, Ni, Mn, Al, Co, Pb и других) - металлическими.
Щелочные мыла получают главным образом из стеариновой, пальмитиновой, лауриновой, олеиновой, нафтеновых кислот, канифоли и таллового масла.
Индивидуальные соли высших жирных кислот - кристаллические вещества; плотность около 1,05 г/см 3 , т. пл. 225-260 °С. В зависимости от условий кристаллизации мыла существуют в моноклинной или ромбической форме; последняя характеризуется лучшей растворимостью в воде. При наличии в мыле ничтожных количеств воды температураплавления понижается до 100°С. Соли ненасыщенных жирных кислот лучше растворимых в воде и труднее кристаллизуются, чем соли насыщенных. Безводные мыла гигроскопичны; их гигроскопичность зависит от природы кислотного остатка и связанного с ним катиона. При повышенных температурах мыла и вода смешиваются во всех отношениях; при комнатной - водные растворы мыла образуют твердые гели, содержащие воду, макс. кол-во которой зависит от природы жирной кислоты и иона металла. При определенной концентрации мыла образуют мицеллярныерастворы и проявляют максимальное моющее действие. Важная характеристика мыла-концентрация, при которой происходит образование мицелл, называют критической концентрацией мицеллообразования (см. табл.). В области критической концентрации свойства растворов мыла (поверхностное натяжение, электрическая проводимость, осмотическое давление и др.) резко изменяются.
Детергенты (лат. detergens, detergentis очищающий) - поверхностно-активные вещества; в медицине используются в качестве моющих и дезинфицирующих средств, применяются также при изготовлении некоторых фармацевтических, в т.ч. ферментных, препаратов, в пищевой промышленности и др.
Поверхностно-активные вещества (ПАВ) при добавлении к так называемым дисперсным системам концентрируются на границе раздела фаз, вызывают снижение поверхностного (межфазного) натяжения и дают возможность этим прежде четко разделенным фазам «проникать» друг в друга, т.е. растворяться. В воде молекулы Д. при определенной концентрации, превышающей так называемую критическую концентрацию мицеллообразования (в среднем от 10 -2 до 10 -4 моль/л ), объединяются в агрегаты (мицеллы). С липидами, белками, каротиноидами и другими нерастворимыми в воде веществами Д. образуют смешанные мицеллы, способствуя тем самым переходу этих веществ в раствор (на этом основано применение Д. в качестве моющих средств) и иногда - изменению их химических свойств.
Желчные кислоты и их соли обладают свойствами Д. и, попадая с желчью в тонкую кишку, взаимодействуют с липидами пищи, делают их водорастворимыми и тем самым доступными для расщепления липолитическими ферментами пищеварительного тракта и способными всасываться в кишечнике. Некоторые ПАВ (например, додецилсульфат натрия) вызывают диссоциацию белковых комплексов. Такие ПАВ способны инактивировать вирусы и бактериальные токсины.
Ряд ПАВ, обладающих сильным бактерицидным действием, применяют для дезинфекции белья в прачечных, стеклянной посуды в учреждениях общественного питания и больницах, мытья и обеззараживания медицинского инструментария. Различные моющие средства , являющиеся Д., получили широкое распространение. Такие ПАВ, как жировое мыло, стиральные порошки типа «Новость», сульфанол и др., используют для дезактивации. Многие Д.
являются хорошими пенообразователями и эмульгаторами, благодаря чему они применяются для приготовления лекарственных эмульсий и мазей (см. Лекарственные формы ), косметических препаратов (кремов и т.п.), маргаринов, майонезов и др.
33 Оксикислоты. Яблочнвая, молочная,и лимонная кислоты. Химические свойства ,Оксикислоты - производные кислот, которые получаются в результате замещения одного или нескольких атомов водорода в радикале кислоты одной или несколькими гидроксильными (спиртовыми) группами.
В простейших случаях оксикислоты содержат одну карбоксильную и одну гидроксогруппу, тогда их общая формула будет:
| (ОН) m |
| R |
Таким образом, оксикислоты имеют две различные функциональные группы: карбоксильную (кислотную) и гидроксильную (спиртовую) группы.
Соединения, содержащие различные функциональные группы, обычно называются соединениями со смешанными функциями.
В зависимости от наличия одного или нескольких карбоксилов оксикислоты делят на одноосновные (с одним карбоксилом), двухосновные (с двумя карбоксилами), трехосновные (с тремя карбоксилами) и т. д.
По числу спиртовых гидроксилов различают монооксикислоты (с одним гидроксилом), диоксикислоты (с двумя гидроксилами) и т. д.
В большинстве случаев оксикислоты обозначают эмпирическими наименованиями – по нахождению в том или ином продукте и т.д.
Например, одноосновная кислота с тремя атомами углерода, найденная впервые в молоке, называется молочной кислотой; двухосновная оксикислота с четырьмя атомами углерода, впервые найденная в яблоках – яблочной кислотой, и т. д.Наряду с этими названиями пользуются и другими, например, прибавляя слово окси- к названию той кислоты, от которой производится данная оксикислота путем замещения водорода на гидроксил. Так, молочной кислоте (с тремя атомами углерода) соответствует пропионовая СН 3 –СН 2 –СООН, и поэтому молочную кислоту называют также оксипропионовой кислотой, а яблочную – оксиянтарной кислотой. Место гидроксильной группы оксикислоты обозначают обычно греческой буквой, начиная обозначения атомов в углеродной цепи в порядке греческого алфавита от того атома углерода, который непосредственно связан с карбоксильной группой. Поэтому более точное название молочной кислоты – с обозначением места гидроксила – α-оксипропио-новая кислота (альфа-оксипропионовая кислота):
| СН 3 −СН−С |
| ОH |
| O |
| ОН |
| α |
| β |
| СН 3 −СН−С |
| ОH |
| O |
| ОН |
Молочная кислота (соли лактаты) CH3CH(OH)COOH. Широко распространена в природе, является продуктом молочнокислого брожения углеводов. Содержит асимметрический атом углерода и существует в виде двух энантиомеров. В природе встречаются оба энантиомера молочной кислоты. При молочнокислом брожении образуется рацемическая D,L-молочная кислота. D-молочная (мясо-молочная) кислота образуется при восстановлении пировиногралной кислоты под действием кофермента НАД Н и накапливается в мышцах при интенсивной работе.
Похожая информация.